短暂的社交经历(例如,性经历)可导致内部状态的长期变化并影响社会行为,如交配、攻击。例如,在成功交配射精后,许多物种迅速表现出对交配倾向的抑制有数小时、数天或更长时间,这种效应称为性满足。这种抑制不仅对于避免过度冒险或寻找新的性伴侣至关重要,而且对于提高受精率也是必不可少的。然而,对于这种依赖经验的变化如何在神经回路中表现并对行为决策产生长期影响,人们知之甚少。
2023年2月10日,北京脑科学与类脑研究中心李莹课题组在顶级期刊《科学》上发表题为“Hyperexcited limbic neurons represent sexual satiety and reduce mating motivation”的研究论文。该研究发现射精经历选择性激活了终纹(BNST)床核中表达雌激素受体2(Esr2)的神经元-BNSTEsr2—并导致发射阈值数天持续下降,在此期间小鼠表现出性满足。抑制过度兴奋的BNSTEsr2在两性饱腹小鼠中引起快速交配恢复。在雄性中,这种过度兴奋降低了交配动机,并且部分由较大的HCN电流介导。因此,BNSTEsr2不仅编码特定的交配动作,而且还代表性满足感的持续状态,神经元离子通道的改变有助于性经验依赖配驱动的长期变化。
该研究工作由北京脑科学与类脑研究中心李莹课题组完成。北京脑科学与类脑研究中心自招博士后周小娟、博士李昂、技术员弭雪为该研究论文的共同第一作者,研究员李莹为通讯作者。

1. 射精是驱动两性性饱足状态的关键事件
那么,什么是导致小鼠性饱足的关键因素?研究人员设计雌雄小鼠经历多次插入但在射精前与伴侣分开(没有经历射精)的对照组,发现对照组没有表现出性饱足,这表明射精是驱动两性性饱足状态的关键事件(图1)。
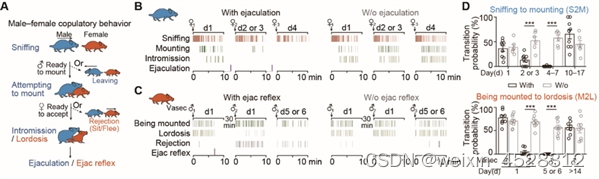
图1.射精是导致两性动物进入性饱足状态的关键事件。
为研究两性小鼠性饱足状态的神经机制,研究人员通过查阅文献发现,在大鼠和长尾鼠中,射精诱导的Fos蛋白表达,存在于犁鼻通路的多个脑区,包括终纹后床核(BNST)、中央杏仁核(MeA)和内侧束旁丘脑核(mSPF),但不包括内侧视前区(mPOA)。使用荧光原位杂交(FISH)方法,研究人员发现完成射精的雄鼠与只经历了3-5次插入但没有射精的雄鼠相比,BNST中Fos+神经元数量变化最大。因此,研究人员聚焦在BNST脑区进行深入研究。
过往单核细胞测序(RNA-seq)实验表明,BNST中包含两类具有性别二态性的神经元亚群:BNSTEsr2 和BNSTSt18。通过在自由运动的小鼠中进行钙成像发现,大量BNSTEsr2 神经元(>50%)在雄性动物射精以及雌性动物感受到射精时均被强烈激活,而在交配的其他阶段没有明显反应。相反,该区域中另一群表达St18的神经元(BNSTSt18)主要在社交嗅探和其他交配过程中被激活,在射精时没有明显反应 (图2)。
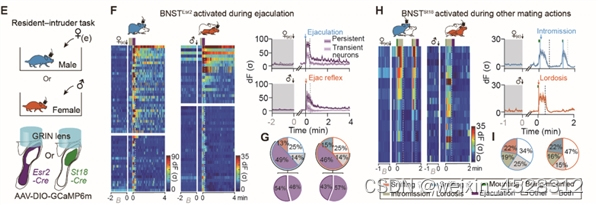
图2. 射精选择性激活两性BNSTpr中表达Esr2的神经元
2. 过度兴奋的BNSTEsr2神经元持续编码两性动物的性饱足状态
雌雄分离后,射精激活的BNSTEsr2神经元反应显著降低,但有一部分神经元在射精结束后30分钟仍保持较强的自发活动,提示这部分神经元可能编码持续性饱足状态。为了进一步检查BNSTEsr2神经元活动是否编码性饱足状态,研究人员将只进行过社会接触、交配但没有性饱足的雄鼠,与交配后达到性饱足的雄鼠独处时的自发放电作比较,发现只有达到性饱足的雄鼠表现出更大幅度和更高频的自发Ca2+活动,并且这种现象可以在整个性饱足期持续数天。当雄鼠恢复交配能力后,自发Ca2+活动就会恢复到基线水平,并在再次交配且达到性饱足后重新升高。
与雄鼠一致,雌鼠在交配后24小时BNSTEsr2神经元的自发Ca2+活动也会明显增加,并与是否受孕成功无关。这种增加通常持续整个假孕期、怀孕期和哺乳期,在交配行为恢复后降低到基线水平。
3. 激活雄鼠BNSTEsr2神经元抑制交配动机
研究人员在Esr2-Cre小鼠双侧的BNST中表达抑制性化学遗传病毒hM4Di,并在达到性饱足状态的雄鼠腹膜内注射氯氮平-N-氧化物(CNO)来抑制BNSTEsr2神经元活动。实验发现,七分之六的雄鼠可以在30分钟内恢复其交配行为并成功射精。同样的操作在刚完成交配处于性饱足期的雌鼠中也可以显著恢复其性接受能力。
为了进一步区分BNSTEsr2神经元是可以抑制交配行为还是交配动机,在雄鼠中,研究人员表达了具有超高光敏感性的视蛋白(SOUL),并在不同的交配阶段进行了经颅光学刺激非侵入性地激活BNSTEsr2神经元。实验发现在嗅探阶段而不是交配开始以后激活BNSTEsr2 神经元可以抑制正常雄性小鼠交配起始,这些发现进一步表明BNSTEsr2 神经元在抑制交配动机而不是交配动作方面发挥了重要的作用。
4. BNSTEsr2神经元中HCN离子通道表达上升参与调节雄性小鼠性饱足状态
为了解BNSTEsr2神经活动持续变化的机制,研究人员使用全细胞膜片钳方法,分别在无性经验、性饱足和交配能力恢复的两性小鼠中,记录了BNSTEsr2神经元的电生理特性。在雄性和雌性小鼠中,与无性经验和交配能力恢复的小鼠相比,性饱足(交配后 36-48 小时)小鼠具有更多BNSTEsr2神经元表现出更高兴奋性。尽管输入电阻和膜电容相当,但在性饱足的BNSTEsr2神经元中,静息膜电位 (RMP) 最高,而rheobases(引发全或无放电所需的最负阶跃电流)最低,提示较小的去极化即可激发动作电位。这种变化在行为恢复的小鼠中大部分恢复,进一步证明了过度兴奋的BNSTEsr2神经元在编码性饱足状态中的作用。
对已有的BNST单细胞测序结果进行分析,研究人员发现BNSTEsr2神经元中注入负电流显示去极化“下垂”电压,主要由超极化激活的环核苷酸门控 (Hcn) 阳离子通道介导。有趣的是,在雄性小鼠中,性饱足小鼠这种“下垂”电压的大小与无性经验或性恢复小鼠的BNSTEsr2神经元相比显著更大,而该现象在雌性小鼠中并不显著。系统重新分析BNST中已发布的snRNA-seq数据集,研究人员发现Hcn1而不是其他亚基在BNSTp中的Esr2+神经元中相对于其他细胞高度富集。此外,通过FISH方法,研究人员在雄性小鼠的BNSTEsr2 神经元中观察到大量HCN1+Esr2+神经元。
使用CRISPR/Cas9技术在BNSTEsr2神经元选择性敲除Hcn1基因,研究人员发现雄性小鼠表现出明显的性饱足状态缺失。为了进一步测试 HCN通道在调节性饱足感中的作用,研究人员在性饱足小鼠颅内两侧BNST给予ZD-7288(HCN抑制剂)或人工脑脊液(载体对照),约 1 小时后显著恢复了5/6的雄性典型性行为。这些结果表明,在雄性小鼠射精后,HCN通道的激活对于维持性饱足状态是必要的(图3)。
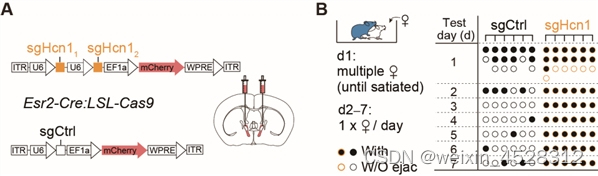
图3. CRISPR/Cas9介导BNSTprEsr2神经元中HCN1敲除后,雄性小鼠能够持续交配
5. 小结
综上所述,该工作在揭示性经验如何引起的大脑内部状态改变这一重要科学问题方面取得了重要突破。这项研究帮助我们理解短暂经验在大脑中持久表征的神经机制,以及这种表征如何长期影响动物行为。此外,该工作还发现短暂性经验可以引起神经元中的离子通道表达的变化,为我们理解性经验如何引起大脑持久改变提供了一个全新的角度 (图4)。
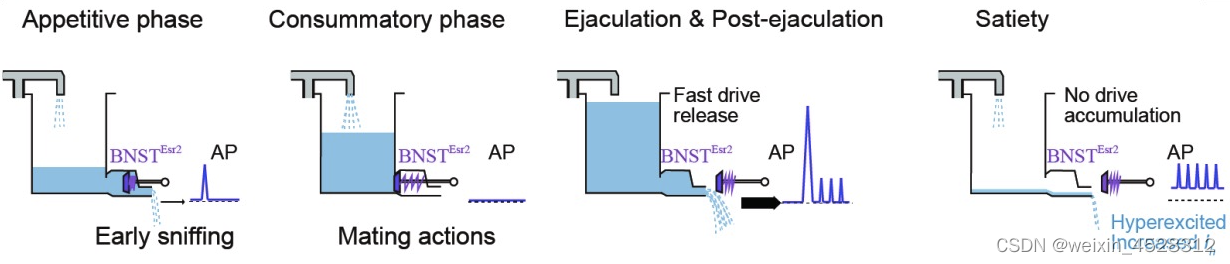
图4. BNSTEsr2 神经元参与调控交配动机的机制解释